Aula 26/09 | professor Paulo Sergio Taube
Livros indicados:
- “Química Geral“, por John B. Russel ou
- “Química, um curso universitário“, por Bruce M. Mahan
~500 a.C – Os atomistas
Os filósofos da antiguidade defenderam a existência de átomos indivisíveis que formariam todas as coisas.
- Demócrito de Abdera intuiu que o cosmos inteiro é constituído por um espaço vazio ilimitado, no qual correm incontáveis grãos indivisíveis dos quais tudo é constituído (átomo, do grego, “a”, negação e “tomo”, divisível. Átomo= indivisível). “É uma visão imensa, ilimitada, incrivelmente simples e forte, sobre a qual mais tarde será construído o saber de uma civilização” (Carlo Rovelli):
- Dança infinita de átomos: esses grãos se movem livremente, chocando-se, unem-se, repelem-se e se prendem uns aos outros; todo pedaço de matéria é constituído por um número finito de pedacinhos distintos, indivisíveis, cada qual com sua dimensão finita.
- Metáfora de Demócrito: do mesmo modo que as letras do alfabeto se combinam de maneiras diferentes formando diferentes histórias, tragédias, comédias, poemas épicos, os átomos elementares combinados obtem o mundo na sua infinita variedade;
- Platão e Aristóteles insistiram em rejeitar as explicações naturalistas de Demócrito
- Império Persa destrói a cidade em 494 a.C. (ou A.E.V – antes da era vulgar).
- Na sequência, “a destruição de todos os textos que não estivessem de acordo com o pensamento cristão foram amplos e sistemáticos, após a brutal repressão antipagã que se seguiu aos éditos do imperador Teodósio (390 dC), que declararam o cristianismo religião única e obrigatória do império”. (Rovelli)
- Ainda no início do século passado, muitos cientistas e filósofos consideram a hipótese atômica uma tolice.
- Depois de 2300 anos: a prova definitiva da “hipótese atômica” teve de esperar até 1905, quando Albert Einstein a partir das observações de Brown sobre a deriva dos grãozinhos nos fluidos, das medidas do quanto eles se movem à deriva, Eistein calculou as dimensões dos átomos de Demócrito, esses grãos elementares de que é feita toda matéria.
Os alquimistas, a química da idade média
A alquimia (do árabe, ‘al-kīmīya’, que significa “a química”) foi praticada por diversas civilizações da Idade Antiga, desde a China até a Grécia Antiga, migrando pro Egito, com os objetivos:
A partir da obtenção da Pedra Filosofal, uma substância mística, conseguir:
- transmutar os metais inferiores ao ouro, transformando-os em ouro;
- obter o elixir da longa vida.
Os alquimistas acreditavam que o mundo material é composto por matéria-prima sob várias formas, as primeiras dessas formas eram os quatro elementos (água, fogo, terra e ar), divididos em duas qualidades: Úmido (que trabalhava principalmente com o orvalho), Seco, Frio ou Quente.
1627 – Robert Boyle, o químico cético
- ficou conhecido como o primeiro cientista a manter anotações detalhadas dos resultados que obtia em seu laboratório;
- anotava passo a passo os experimentos que realizava, comparava os resultados e tecia hipóteses;
- negava qualquer explicação mágica para os fenômenos naturais, sendo considerado um dos fundadores da Química.
- Lei de Boyle (1662): a pressão absoluta e o volume de uma certa quantidade de gás confinado são inversamente proporcionais se a temperatura permanece constante em um sistema fechado.
- PV = k (constante)
1743-1894 – Lavoisier descobriu a massa constante
- considerado o pai da química moderna
- descobriu que a água é uma substância composta, formada por dois átomos de hidrogénio e um de oxigénio: H2O.
- 1787 – iniciou um trabalho de elaboração de uma nomenclatura mais racional, junto com outros químicos;
- O Princípio da Conservação da Massa: “Na Natureza, nada se cria, nada se perde, tudo se transforma“.
1797 – Joseph Louis Proust descobriu as proporções
- As reações acontecem em proporções fixas:
- Lei de Proust: “A massa final de um recipiente fechado, após ocorrer dentro dele uma reação química, é sempre igual a massa inicial.“
1808 – John Dalton estabelece o modelo atômico “Bola de Bilhar”
- propôs o primeiro modelo científico que explica o átomo como Bola de Bilhar:
- é esférico;
- é maciço;
- é indestrutível;
- é indivisível.
- definiu o que viria a ser elemento químico
- para ele, conjunto de átomos com mesmo número de massa (o q é errado) e propriedades iguais
- começou a fazer uma primeira mini-tabela periódica
- se baseou nas leis da conservação das massas (lavoisier) e das proporções múltiplas (proust), para falar que elementos poderiam se combinar e formar compostos
- não ressaltou a natureza elétrica da matéria
1869 – Meyer-Mendeleiv criam a primeira tabela periódica com elementos organizados em períodos
Nesse período, ainda pouco se sabia a respeito da constituição dos átomos, mas a organização proposta por Meyer-Mendeleiev originou inúmeras investigações para justificar a periodicidade dos elementos e constitui a base da atual Tabela Periódica.
1897 – J. Thomson descobriu os elétrons e propôs o modelo atômico “Pudim de Ameixa”
Thomson descobriu partículas negativas (elétrons) quando estudava as descargas elétricas de partículas catódicas.
- apresentou as primeiras ideias relativas à estrutura interna dos átomos;
- Thomson indicava que os átomos deviam ser constituídos de cargas elétricas positivas e negativas distribuídas uniformemente;
- descobriu essa mínima partícula e assim estabeleceu a teoria da natureza elétrica da matéria
- não visualizou a eletrosfera, o átomo ainda era maciço, mas os elétrons (as passas do pudim) poderiam ser perdidas.
1905 – Einstein publica a teoria atômica e comprova que Demócrito, o atomista grego, sempre esteve certo em sua intuição
1911 – Rutherford descobriu o núcleo e a eletrosfera e propôs o modelo atômico “Planetário”
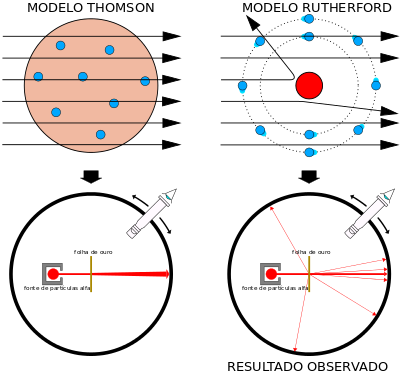
O experimento feito por Geiger e Marsden, alunos de Rutherford, queria mostrar que todas as partículas passariam direto pela fina lâmina de ouro, sem resistência à partícula alfa, mas não foi isso que aconteceu. De fato, algumas partículas passaram, mas outras desviaram e algumas até voltaram, causando o espanto de todos. Se voltaram foi porque a partícula encontrou algo muito denso e com a mesma carga, positiva, gerando repulsão. Então surgiu a ideia de que ali pudesse haver um núcleo, algo que tivesse uma massa grande e uma carga fortemente positiva.
Um átomo é composto por um pequeno núcleo carregado positivamente e rodeado por uma grande eletrosfera cheia de espaços vazios, que é uma região envolta do núcleo que contém elétrons. No núcleo está concentrada a carga positiva e a maior parte da massa do átomo.
- O Modelo Atômico de Rutherford, conhecido como modelo planetário, corresponde a um sistema planetário em miniatura, no qual os elétrons se movem em órbitas circulares, ao redor do núcleo, mas há um grande vazio entre eles.
- previu o núcleo positivo e a eletrosfera negativa;
- não previu que os elétrons poderiam ganhar energia e se mover de camadas, ganhando energia em forma de luz.
1913 – Henry Moseley estabelece o conceito de número atômico e atualiza a tabela periódica de Meyer-Mendeleiv
A partir de seus experimentos, ele atribuiu números inteiros a cada elemento e, posteriormente, foi constatada a correspondência ao número de prótons no núcleo do átomo.
1913 – Bohr aperfeiçoou o modelo atômico de Rutherford (1913), com as órbitas quânticas e propôs o modelo atômico de Rutherford-Bohr
Explicação do átomo baseado na luz emitida por alguns elementos quando ganhavam energia.
- Bohr tratava elétrons como partículas que existiam em órbitas definidas
- Um elétron pode absorver energia na forma de fótons para ser excitado até um nível mais elevado de energia, desde que a energia do fóton seja igual à diferença de energia entre os níveis de energia inicial e final. Depois de saltar para o nível de energia mais alto — também chamado de o estado excitado—o elétron excitado estaria em uma posição menos estável, então, ele poderia rapidamente emitir um fóton para retornar até um nível de energia mais baixo e mais estável.
- Bohr foi o primeiro a reconhecer que a a física clássica não era suficiente para explicar todos os fenômenos em nível atômico, incorporando a ideia de quantização na estrutura eletrônica do átomo.
- Em 1919, Bohr descobriu que dentro do núcleo tem partículas subatômicas positivas, os prótons.
- aperfeiçoou o modelo atômico de Rutherford, elucidando o que os elétrons estavam fazendo ao redor do núcleo. Bohr mostrou que de acordo com a “nova física” as órbitas com elétrons tem a energia quantizada, prevendo a entrada de energia e saltos quânticos para camadas mais externas.
Heisemberg e o princípio da incerteza
- Não é possível saber a posição de um determinado elétron no espaço e sua velocidade ao mesmo tempo, conceito que é colocado mais precisamente no princípio de incerteza de Heisenberg.
- O princípio de incerteza contradiz a ideia de Bohr de que os elétrons existam em órbitas específicas, com velocidade e raio conhecidos. Na verdade, podemos apenas calcular probabilidades de encontrar os elétrons em uma determinada região do espaço ao redor do núcleo.
Schrondinger e a mecânica quântica das orbitais do átomo, os spins dos elétrons
- propôs o modelo da mecânica quântica para átomo, que trata os elétrons como ondas;
- rotação ou spin dos elétrons: essas partículas poderiam exibir duas orientações possíveis, a favor do campo magnético ou contra ele (spin pra cima ou spin pra baixo).
1932 – James Chadwick descobriu a existência dos neutrons no núcleo
Uma partícula que tem massa, mas não tem carga, está no núcleo com os prótons.
1980 – Microscópio de Tunelamento por Varredura (STM)
- o nanoscópio desenvolvido pelos suíços Gerd Binning e Heinrich Rohrer (rendendo o Nobel de Física em 1986);
- Esse tipo de equipamento, porém, não tira uma espécie de foto com a imagem do átomo na superfície do sólido, mas é como se fosse possível “senti-los”, percebendo espécies de “caroços” ou elevações que correspondem ao núcleo dos átomos.
Observações minhas curiosas sobre este mundo invisível:
- o átomo é uma entidade tão minúscula que é impossível visualizá-lo mesmo com os melhores microscópios existentes;
- se Demócrito imaginou o átomo, de certa forma, por nunca tê-los visto, também imaginamos até hoje.