Aula 03/10 | professor Paulo Sergio Taube (pstjunior@yahoo.com.br)
Átomo
Os átomos são formados por um núcleo, que é composto por prótons e nêutrons, e uma eletrosfera, constituída pelos elétrons. Os prótons são partículas de carga positiva; os nêutrons são partículas de carga neutra; os elétrons são partículas de carga negativa.
- Na tabela periódica, o número atômico (Z) é o número de prótons no núcleo.
- Já o peso atômico (A) é o número de prótons mais o número de nêutrons (A = Z + N).
- Para determinar o número de elétrons, se o átomo estiver sem carga, o número é o mesmo que o número atômico. Agora se o átomo não está neutro e tem carga, virando um íon, quando há perda de elétrons, o íon gerado é positivo, sendo chamado de cátion (ex: Na+496 kJ⟶Na++1 e−); se há ganho de elétrons, o íon gerado é negativo, sendo chamado de ânion (ex: Cl+1 e−⟶Cl−+349 kJ).

- Famílias/Grupos (colunas verticais): a tabela periódica possui 18 famílias/grupos no qual os elementos possuem o mesmo número de elétrons em sua camada de valência;
- Períodos (linhas horizontais): indicam elementos que apresentam o mesmo número de camadas eletrônicas (abaixo). Atualmente, a tabela conta com 7 períodos para dispor os elementos conhecidos hoje, mas com o surgimento de novos elementos com mais camadas, o modelo pode ampliar o número de períodos.
Camadas eletrônicas do átomo
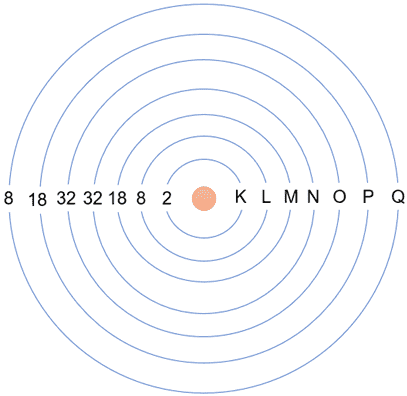
Os elétrons se distribuem na eletrosfera em posições diferentes. O número quântico principal (n) de 1 (K) a 7 (Q), sendo K mais perto do núcleo e Q mais afastado, formam as chamadas camadas eletrônicas. Os elétrons das camadas mais afastadas do núcleo são atraídos por ele com intensidade menor e, portanto, possuem mais energia potencial.
Subníveis das camadas:
São orbitais dentro dos níveis/camadas –número quântico azimutal (l)–, representadas pelas letras s, p, d, f. Cada subnível orbital apresenta um número máximo de elétrons que pode comportar:
- s: 2 elétrons;
- p: 6 elétrons;
- d: 10 elétrons;
- f: 14 elétrons.
Quantos elétrons cada camada e subnível pode comportar?
- K 1º Período – primeira camada bem próxima do núcleo; comporta até 2 elétrons na orbital 1s2
- L 2º Período – segunda camada; comporta até 8 elétrons, sendo 2 na orbital s2 e 6 na orbital p6, 2s22p6
- M 3º Período – terceira camada; comporta até 18 elétrons, sendo 2 na orbital s2, 6 na orbital p6 e 10 na orbital d10, 3s23p63d10
- N 4º Período – quarta camada; comporta até 32 elétrons, sendo 2 na orbital s2, 6 na orbital p6, 10 na orbital d10 e 14 na orbital f14 , 4s24p64d104f14
- O 5º Período – quinta camada; comporta até 32 elétrons, sendo 2 na orbital s2, 6 na orbital p6, 10 na orbital d10 e 14 na orbital f14 , 5s25p65d105f14
- P 6º Período – sexta camada; comporta até 18 elétrons, sendo 2 na orbital s2, 6 na orbital p6 e 10 na orbital d10, 6s26p66d10
- Q 7º Período – sétima camada; comporta até 8 elétrons, sendo 2 na orbital s2 e 6 na orbital p6, 7s27p6
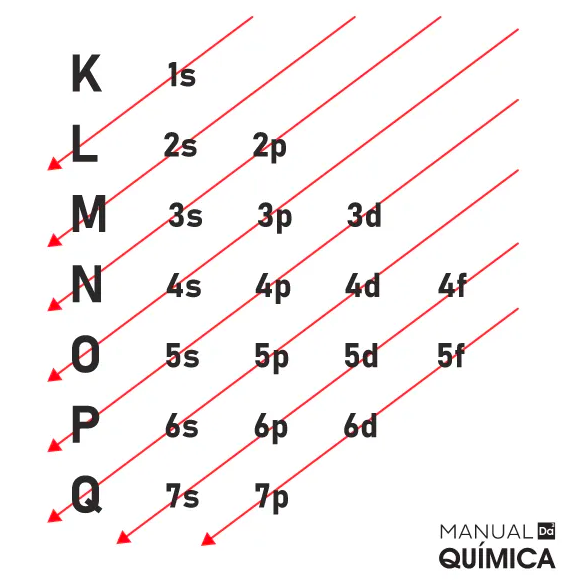
Diagrama de Linus Pauling
Os níveis de energia nas orbitais (regra de Hund)
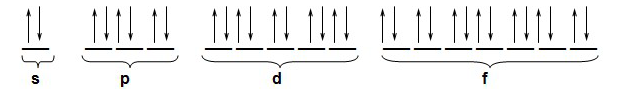
p6= 3 orbitais e 6 spins
d10= 5 orbitais e 10 spins
f14= 7 orbitais e 14 spins
- Orbitais: estado individual que pode ser ocupado por um elétron de um átomo (nível de energia).
Energy ordering of orbitals for multi-electron atoms
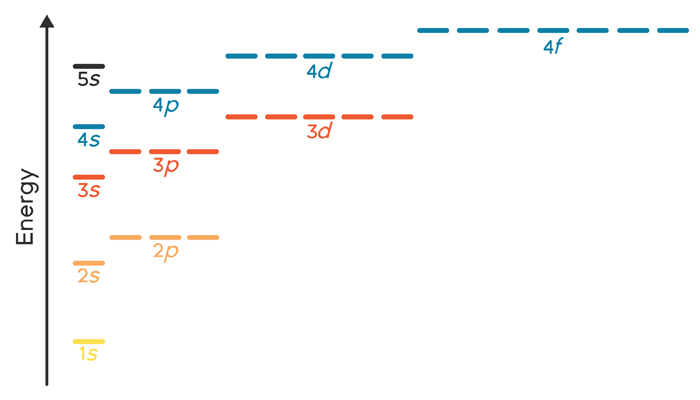
Como fazer a distribuição nas orbitais:
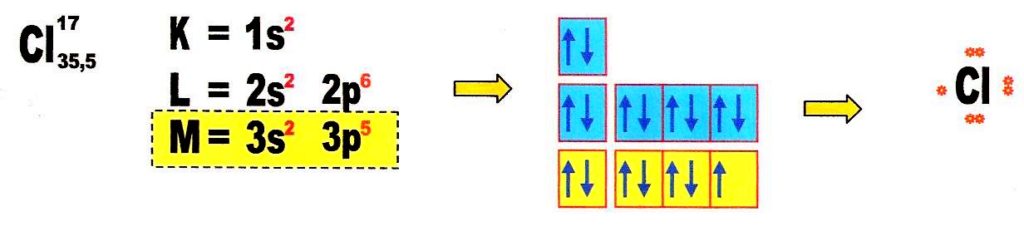
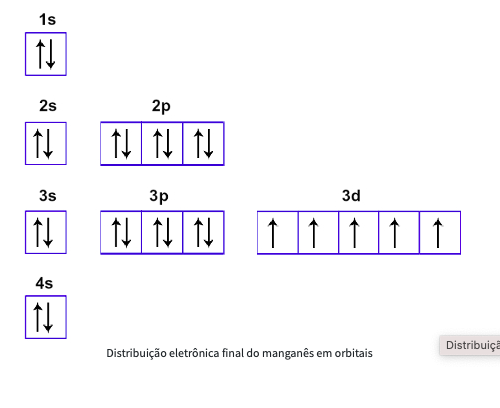
Exemplo de questão de prova: manganês

Primeiro passo: fazer a distribuição seguindo as diagonais do diagrama de Pauling

Temos a seguinte ordem: 1s2 2s2 2p6 3s2 3p6 4s2 3d5
Segundo passo: reorganizamos por camadas – 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Terceiro passo: dispomos os elétrons com seus spins em suas orbitais, por camadas
Propriedades periódicas
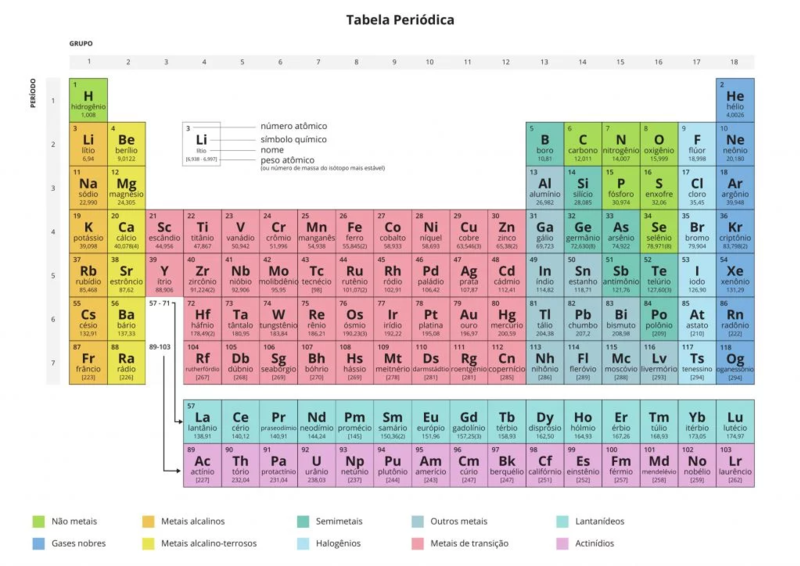
- todos os metais (alcalinos, alcalinos-terrosos, semimetais e metais de transição) são eletropositivos, ou seja, têm tendência de perder elétrons e por isso são bons condutores de eletricidade e calor; são dúcteis –se transformam em fios– e são maleáveis –se transformam em lâminas; porque podem perder elétrons, sofrendo oxidação, tendo um elevado potencial de oxidação. os metais mais usados pela humanidade são o ferro (usado há milênios), o alumínio (mais abundante, mas mais difícil o processo) e o lítio (bateria).
Os períodos são as linhas horizontais numeradas, que apresentam elementos com o mesmo número de camadas eletrônicas, totalizando sete períodos. Quanto maior o período, maior o número de camadas da eletrosfera, logo, maior o raio atômico.
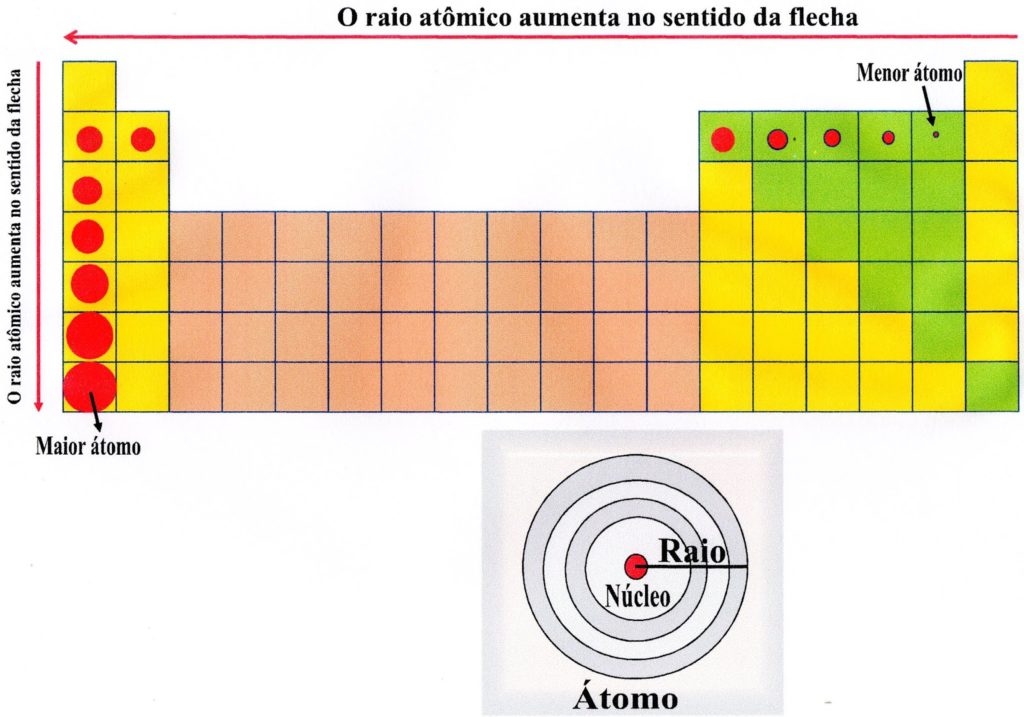
Os grupos são as colunas verticais, onde os elementos possuem o mesmo número de elétrons na camada mais externa, ou seja, na camada de valência.
- De acordo com a Regra do Octeto, a camada de valência precisa de oito elétrons para se estabilizar. Assim, os átomos adquirem estabilidade quando têm 8 elétrons na camada de valência. Isso acontece com os gases nobres, eles apresentam a camada de valência completa. A única exceção é o elemento Hélio que possui 2 elétrons.
Volume Atômico
Essa propriedade periódica indica o volume ocupado por 1 mol do elemento no estado sólido. Vale notar que o volume atômico não é o volume de 1 átomo, mas um conjunto de 6,02.1023 átomos (valor de 1 mol).
Eletronegatividade
Tendência em um átomo receber elétrons e se tornar um íon negativo (Ânion). O esquema também mostra o sentido da energia de ionização, ou seja, energia necessária para retirar um elétron da camada mais externa do átomo (camada de valência).
Dica para lembrar a ordem dos elementos mais eletronegativos, do maior F para o menor H, que devemos saber de cabeça:
F ➞ O ➞ N ➞ Cl ➞ Br ➞ I ➞ S ➞ C ➞ P ➞ H
Fluor ➞ Oxigênio ➞ Nitrogênio ➞ Cloro ➞ Bromo ➞ Iodo ➞ S-enxofre ➞ Carbono ➞ P-fosfóro ➞ Hidrogênio
Fui Ontem No Clube, Briguei I Saí Carregado Pro Hospital
Eletropositividade
Tendência de um átomo perder elétrons e se tornar um íon positivo (Cátion).
Pergunta de prova:
O cobre ocorre na natureza como uma mistura isotópica de 69,09% de 63Cu (massa=62,93 u) e 30,91% 65Cu (massa=64,95 u). Qual a massa atômica do cobre?
MassaP = %/100.m + %/100.m