Ponto de fusão: 0oC
Ponto de ebulição: 100oC
Ponto de vaporização: 2260oC, o maior calor de vaporização
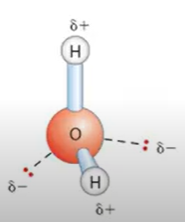
Propriedade H20: Molécula polar
Polaridade: mólecula parcialmente carregada
δ- dois eletrons negativos em cada
O-
H+
A água interage com outras moléculas polares, como a glicose, glicina, aspartato, lactato, glicerol, que possuem OH-, COO- etc.
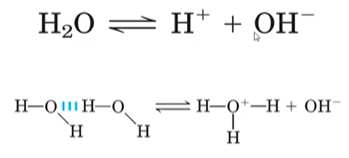
Propriedade H20: Ligação de hidrogênio
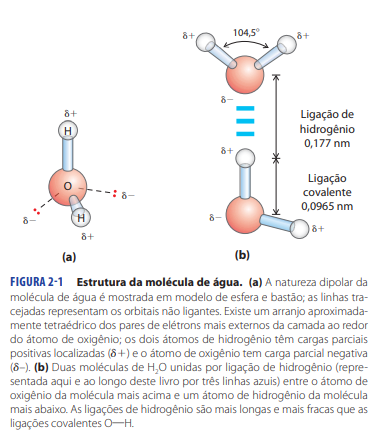
A carga parcialmente negativa do O- (potencializada pelos elétrons sobrando nos δ-) atrai o H+ de outra molécula criando essas interações superfortes chamadas de ponte ou ligação de hidrogênio. Isso explica porque o ponto de ebulição e de vaporização são tão altos, porque cada molécula de água faz interação com outra molécula de água.
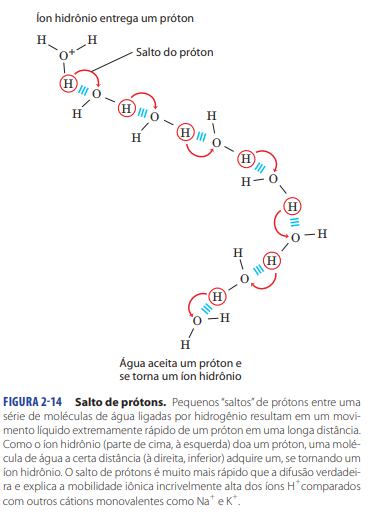
Salto de próton
Propriedade H20: Flickering clusters e tensão superficial da água
Os flickering clusters são agrupamentos de moléculas de água interligadas por ligações de hidrogênio. Esses agrupamentos são de vida curta na água líquida. A soma de todas as ligações de hidrogênio entre as moléculas de água do agrupamento confere à estrutura uma grande coesão interna.
Exemplo: barrigada dolorida na água. No momento do mergulho, a somatória das pontes de hidrogênio dos flickering custers gera uma estrutura cuja força normal resiste ao peso do abdomen e por isso o impacto causa dor.

Pelo mesmo motivo a água não transborda da gota de orvalho e tem formato esférico. Também por isso alguns insetos conseguem andar sobre a água, uma pedrinha pode quicar no rio antes de afundar.
Propriedade H20: Ligação de hidrogênio no gelo (estado sólido)
As moléculas se orientam melhor umas para as outras, com pelo menos quatro interações feitas por cada molécula de água, formando uma estrutura hexagonal com espaços . Por isso a água espande quando congela, a estrutura tridimensional forma regiões com grandes vazios.
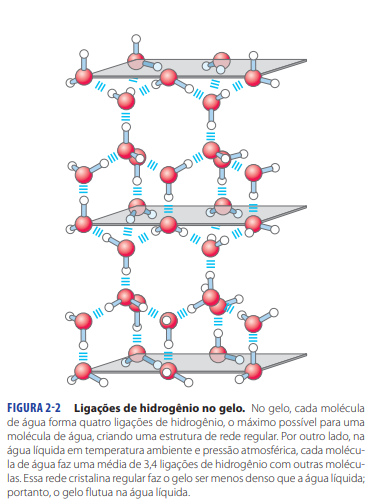
No estado líquido, todas as moléculas são mantidas juntas e livres para se mover. Quando a água atinge o estado sólido (gelo), as moléculas se organizam de tal maneira que os átomos de oxigênio se afastam uns dos outros, mantendo uma posição fixa com uma distância entre elas e formando uma estrutura cristalina tridimensional. Isso acontece graças à organização das ligações de hidrogênio, que cria cavidades numa estrutura hexagonal. Por causa dos espaços vazios, o gelo fica com uma densidade menor e flutua!
Propriedade H20: Solubilidade e rastreamento de cargas
Por causa de sua polaridade, a molécula de H20 é capaz de separar cargas. Abaixo, um cristal de cloreto de sódio (Na+Cl–), organizado atomicamente em cubo.
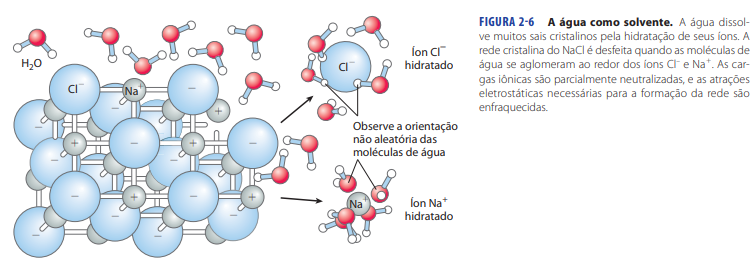
A dissolução do cristal Na+Cl– sólido é rompida pela água que separa as cargas e hidratas os íons. O íon Na+ é solvatado pela face negativa do dipolo da água (átomo de oxigênio) e o íon Cl– pela face positiva (íons de hidrogênio).
A água vai sempre dissolver algo com carga, com grande constante dielétrica (ε).
Os gases em sua maioria são compostos apolares, sendo pouco solúveis em água (O2, N2, CO2). Exceção feita para a amônia NH3 e H2S, que são polares, e dissolvem muito fácil, sendo tóxico.
Por isso, o O2 é transportado por proteínas transportadoras, como a hemoglobina que são bombeadas pelo coração (seres aeróbios). Já o CO2 é convertido em bicarbonato, um íon solúvel em água, que percorre a circulação e atinge os alvéolos.
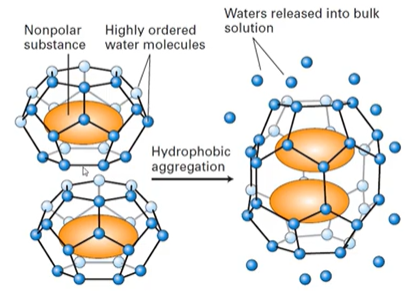
Propriedade H20: Efeito hidrofóbico
Na presença de lipídio, a água começa a se ordenar em volta dele para isolá-lo. A água vai tentar excluir o que é apolar, dirigido por aumento de entropia. As moléculas de água altamente ordenadas formam “gaiolas” ao redor das cadeias de grupos polares.
O que é micela?
É um agregado lipídico que possui todas as caudas apolares apontadas para dentro e as cabeças polares apontadas para fora, fazendo ponte de hidrogênio com a água.
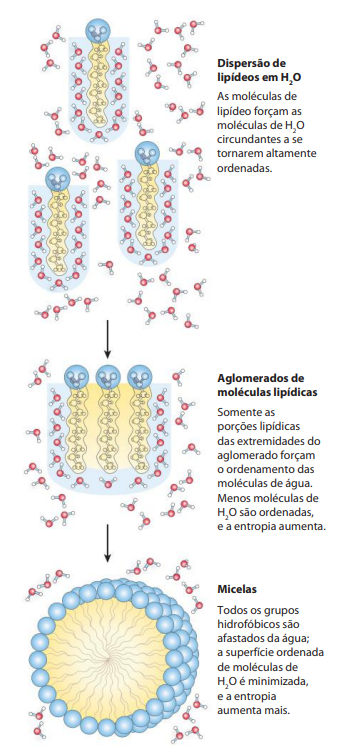
A quantidade suficiente de lipídios forma micelas de núcleo apolar e exterior polar. Ocorre a liberação de mais moléculas de água que estavam organizadas e isso aumenta a entropia do sistema.
Propriedade H20: Pressão osmótica
A água tende a se mover de onde tem maior concentração de H20 para onde tem menor concentração, por difusão (aumenta a entropia do sistema). A osmose é o movimento da água através de uma membrana semipermeável ocasionado por diferenças na pressão osmótica. O principal fator impulsionador da osmose é o potencial químico da água, que é determinado pela concentração de solutos. Quando há uma diferença na concentração de solutos de um lado de uma membrana semipermeável para o outro, a água tenderá a se mover através da membrana da área de baixa concentração de solutos para a área de alta concentração de solutos para igualar as concentrações. Isso ocorre até que um equilíbrio osmótico seja alcançado.
Solução hipertônica: a água se movimenta para fora da célula e a mesma encolhe.
Solução hipotônica: a água se movimenta pra dentro da célula e causa inchaço podendo romper a membrana.
Propriedade H20: o Ph e a Constante de equilíbrio
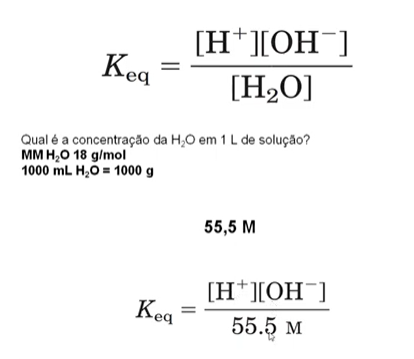
Se a concentração de H+ variar, a concentração de OH- também varia.

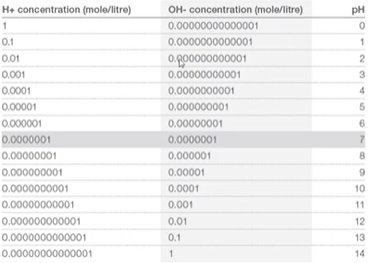
Na água pura, a solução está em pH neutro, quando as concentrações de H+ e OH- são iguais.
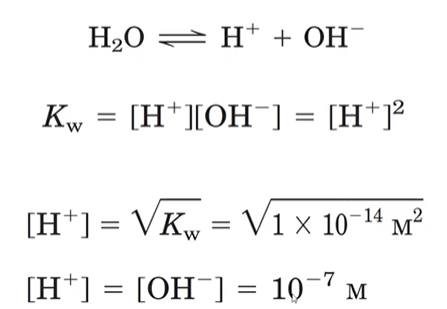
O pH neutro (7) quer dizer que as concentrações de OH- e H+ são as mesmas, 10-7 para cada, porque a constante de equilíbro (Kw) do OH- e H+ é 10-14.
O H+ faz um salto de próton (proton hopping), se tornando um hidrônio.
Saiba mais:
Livro de referência da disciplina
Aula da USP – parte 1
Aula da USP: parte 2