O gás é definido pelas suas propriedades:
- pressão (p)
- volume (v)
- temperatura (t)
- número de mols (n)
pv = nRT
Pressão
p = F/ A
Pascal e Torricelli
entender as diferentes unidades para pressão
Pa — pascal
Torr – torricelli
mmHg – milimetros de mercúrio
Da maior pressão para a menor pressão
Volume
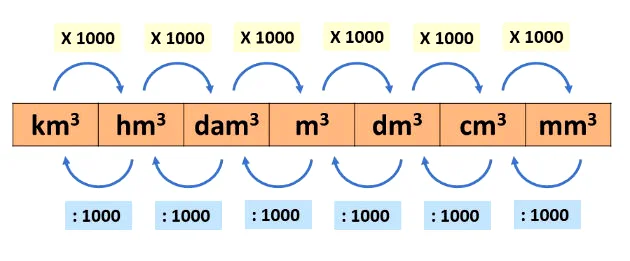
1m3 = 1000 L
1L = dm3
tabela de transformação de 1m3 até dm3
Temperatura
Kelvin
Lei Zero da Termodinâmica
Se um corpo A está em equilíbrio com um corpo B e se o corpo B está em equilíbrio térmico com um corpo C, então o corpo C também está em equilíbrio térmico com A.
Lei de Boyle
Sob condições isotérmicas (temperatura constante), a pressão de uma amostra de gás é inversamente proporcional ao seu volume e vice=versa.
p.V = K (constante para uma dada temperatura)
p = K/V (pressão inversamente igual ao volume)
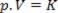
em um gráfico p/ por 1/v, quanto mais proximo da pressão estiver, mais temperatura
definir a lei de Gay-Lussac ou lei de Charles, contextualizar, exemplos e exercícios
definir o que é um gás ideal e um gás real
definir a lei de gases ideias
definir a lei de dalton dando exemplos